关防风根腐病拮抗细菌筛选与鉴定
防风[Saposhnikovia divaricata (Turcz.) Schischk]为伞形科多年生草本药用植物,以干燥根入药[],有解表发汗、祛风除湿、止痛的功效,是我国常用的大宗中药材之一[]。东北产的防风为道地药材,素有“关防风”之称,主产于黑龙江安达、泰康和吉林洮安及辽宁昭盟、铁岭等地区[]。供给市场的关防风主要以人工栽培为主[],但近年来由于关防风人工栽培技术体系不够完善,导致关防风根腐病、立枯病和灰霉病等10余种病害时有发生,其中由木贼镰刀菌[Fusarium equiseti (Corda) Sacc.]引起的关防风根腐病危害较为严重,一般减产20%−30%,严重时可达到50%−60%[]。目前对于关防风根腐病的防控仍依赖于化学途径[],但长期大量施用化学农药引发的病原菌抗药性不断增强[]、农药残留和环境污染等问题,严重影响关防风的品质和商业价值,极大地限制了关防风产业的可持续发展,因此亟需开辟关防风根腐病绿色防控新途径。
生物防控作为一种绿色、安全、有效的病害管理途径[],目前在生态农业中已广泛应用[-],是药用植物病害防控领域的研究热点之一。研究表明,以木霉属真菌(Trichoderma sp.)和芽胞杆菌(Bacillus sp.)所研制的生物菌剂,对根腐病、灰霉病和立枯病等多种植物病害具有良好的防控效果,但是市场上已推广的菌剂对植物特定病害的防控存在着针对性不强的问题。市面上生产的哈茨木霉菌剂和枯草芽胞杆菌菌剂对向日葵黄萎病的防效仅为33.75%和17.65%[]。因此,从自然生境中筛选高效的拮抗菌株对开展植物病害生物防控工作至关重要。
研究表明植物根际土壤中的拮抗细菌具有良好的生防潜力[-]。目前关于关防风拮抗菌的研究鲜有报道,并且都只是针对关防风内生菌的研究[-],而关于关防风根际土壤细菌的研究还未见报道,因此,本研究以关防风根际土壤为研究对象,从中分离筛选出对木贼镰刀菌具有显著抑制作用且具有广谱抑菌活性和良好定殖能力的拮抗细菌,通过形态学、生理生化特征及16S rRNA基因序列确定其分类学地位,并考察其室外盆栽防病效果,以期为关防风根腐病等真菌性病害的生物防控研究提供针对性强的优质菌源,同时为我国药用植物病害防控相关研究奠定理论基础。
1 材料与方法 1.1 材料 1.1.1 样品关防风根腐病病原真菌木贼镰刀菌(F. equiseti)用于拮抗细菌的筛选。
九种常见作物病原真菌:关防风灰霉病病原真菌灰葡萄孢菌(Botrytis cinerea Pers. ex Fr.)、关防风立枯病病原真菌立枯丝核菌(Rhizoctonia solani Kühn)、关防风疫病病原真菌恶疫霉菌[Phytophthora cactorum (Leb et Cohn) Schort.]、关防风枯萎病病原真菌尖孢镰刀菌(Fusarium oxysporum Schlecht.)、五味子黑斑病病原真菌鹅掌楸链格孢菌[Alternaria liriodendra T. Y. Zhang et J. Z. Zhang]、五味子茎基腐病病原真菌腐皮镰孢菌[Fusarium solani (mart.) App. et Wollenw]、细辛叶枯病病原真菌槭菌刺孢菌[Mycocentrospora acerina (Hartig) Deighton.]、刺五加黑斑病病原真菌细极链格孢菌[Alternaria tenuissima (Fr) Wiltshire]和细辛菌核病病原真菌核盘菌(Sclerotinia asari Wu et C. R. Wang.),用于拮抗细菌抗菌谱测定。以上病原真菌均由吉林农业大学植物病理实验室提供。
采用五点取样法,于吉林农业大学药园(E125°24′59″,N43°48′24″,海拔251 m)、吉林省白城市黑水镇(E122°52′10.43″,N45°11′39.01″,海拔152 m)、吉林省洮南市永茂林场(E122°12′38.32″,N45°31′58.59″,海拔224 m)的健康关防风种植地进行土壤样品采集。根际土壤收集采用抖落法:拔出根系,去除根围土,将离主根和须根根轴表面0−5 mm之内附着的土壤抖到自封袋中,4 ℃保存、备用。
1.1.2 培养基牛肉膏蛋白胨(NA)培养基参照文献[]配制;马铃薯葡萄糖(PDA)培养基参照文献[]配制;西蒙氏柠檬酸盐培养基、硝酸盐肉汤培养基、明胶水解培养基、淀粉水解培养基和V-P培养基等鉴定培养基参照文献[]配制。
1.1.3 主要试剂和仪器99%利福平(rifampicin,Rif),北京索莱宝科技有限公司;70%代森锰锌800倍液,四川润尔科技有限公司;哈茨木霉菌剂,潍坊奥奇生物科技有限公司;枯草芽胞杆菌菌剂,山东鲁抗生物农药有限责任公司;细菌基因组试剂盒,TaKaRa公司;DNA Marker和细菌引物,生工生物工程(上海)股份有限公司。细菌生理生化鉴定管,青岛海博生物科技有限公司;人工气候箱,哈尔滨东联电子科技有限公司;PCR仪,Rockwell Allen-Bradley公司;水平电泳仪,北京六一生物科技有限公司;凝胶成像系统,上海天能科技有限公司。
1.2 土壤细菌的分离采用稀释平板法分离土壤细菌[]。称取已过20目筛的土样10 g,置于250 mL三角瓶中,加入90 mL无菌水和少许玻璃珠,30 ℃、180 r/min充分振荡20 min,混匀后静置5 min,制得土壤悬液。按10−3、10−4、10−5梯度制成稀释液,分别吸取200 μL各稀释液在NA平板均匀涂布,每个处理3次重复,平板倒置于恒温培养箱内32 ℃暗培养24−48 h。根据菌落形态、颜色、边缘和可溶性色素等特征挑取不同的细菌菌落,进行NA平板划线纯化,编号,4 ℃保存备用。
1.3 拮抗细菌筛选 1.3.1 滤纸片法初筛[]细菌发酵液的制备:将供试细菌接种于NA液体培养基中,32 ℃、180 r/min振荡培养36 h制得细菌发酵液,加入灭菌水调整含菌量为108 CFU/mL,置于室温备用。
将木贼镰刀菌制成直径8 mm的菌饼,接种至PDA平板正中央,同时将4片灭菌滤纸圆片(直径8 mm)对称置于距平板中心约25 mm处,每片点接20 μL细菌培养液,对照组点接20 μL的NA液体培养基,每处理3次重复,置于30 ℃培养箱暗培养,待对照组菌落长满平板,计算抑菌率。筛选出有明显拮抗作用的细菌菌株进行复筛。
1.3.2 牛津杯法复筛[]无菌滤液的制备:将供试细菌发酵液于4 ℃、7 000 r/min离心20 min,收集上清液经0.22 μm微孔滤膜过滤掉菌体后,制得无菌滤液,4 ℃保存备用。
将木贼镰刀菌制成直径8 mm的菌饼,接种至PDA平板正中央,无菌条件下将4个已灭菌牛津杯(内径6 mm,外径8 mm,高10 mm)对称放于距平板中心约25 mm处,每杯接入200 μL无菌滤液,对照组接入200 μL的NA液体培养基,每处理3次重复,置于30 ℃培养箱暗培养,待对照组菌落长满平板,测量、记录处理组真菌菌落生长直径(十字交叉法),计算供试细菌滤液的抑菌率。
$ 抑菌率=[(A–B)/(A–8)]×100% $式中,A:对照组病原真菌的生长直径;B:处理组病原真菌的生长直径,数字为病原菌菌饼直径。
1.4 抗利福平(Rif)突变菌株的筛选采用抗生素标记法[],取拮抗细菌发酵液10 mL接种在含10 μg/mL Rif的50 mL NA培养液中。32 ℃、180 r/min振荡培养,逐步筛选出能在300 μg/mL Rif的NA培养液中稳定生长且拮抗活性、菌落形态变化不大的突变菌株进行下一步实验。
1.4.1 突变菌株遗传稳定性检测将突变菌株在NA液体培养基(不含Rif)中继代培养10代后,涂布于含300 μg/mL Rif的NA培养基平板,观察是否能正常生长。
1.4.2 突变菌株拮抗稳定性检测采用滤纸片法,以原始菌株为对照,观察抑菌率是否存在差异。
1.5 抗利福平突变菌株在土壤中的定殖采用拌土接种法[],将300 g土壤放入育苗盆中,并向盆中注入30 mL突变菌株发酵液(初始菌量108 CFU/g)均匀拌土,3次重复处理,室温下放置,每隔7 d定期取样,采用土壤稀释法将土壤稀释液涂布在含300 μg/mL Rif的NA培养基平板上,计算含菌量。
1.6 拮抗细菌抗菌谱测定采用滤纸片法,以供试9种常见作物真菌性病害致病菌为靶标菌,对定殖能力较好的拮抗细菌进行抗菌谱的测定,每处理3次重复,置于30 ℃培养箱暗培养,待对照组菌落长满平板,计算抑制率。
1.7 拮抗细菌盆栽防效研究木贼镰刀菌孢子悬液的制备:将已活化好的木贼镰刀菌用打孔器打成直径8 mm的菌饼,挑取5−6块菌饼放入装有PDA液体培养基的锥形瓶中,25 ℃、180 r/min振荡培养7 d,用4层灭菌纱布过滤,在显微镜下用血球计数板调整孢子浓度为108 CFU/mL。
拮抗细菌发酵液的制备:将定殖效果良好的拮抗细菌接种于NA液体培养基中,32 ℃、180 r/min振荡培养4 d,制得拮抗细菌发酵液,用灭菌水调整含菌量为108 CFU/mL,置于室温下备用。
盆栽试验设置6个处理:处理1:单接木贼镰刀菌孢子悬液15 mL;处理2:哈茨木霉菌剂(孢子浓度为108 CFU/mL)与木贼镰刀菌孢子悬液各15 mL混合接种;处理3:枯草芽胞菌剂(含菌量为108 CFU/mL)与木贼镰刀菌孢子悬液各15 mL混合接种;处理4:70%代森锰锌800倍液与木贼镰刀菌孢子悬液各15 mL混合接种;处理5:拮抗细菌SC-16发酵液与木贼镰刀菌孢子悬液各15 mL混合接种;处理6:拮抗细菌SC-119发酵液与木贼镰刀菌孢子悬液各15 mL混合接种,每处理8个重复。
接种方式:选取长势一致且健康的一年生关防风植株,采用伤根灌注法[],用刀片在距关防风茎基1−2 cm处划伤,从伤口处灌入上述处理组菌液。常规管理,接种后35 d进行病害调查,参照胡容平[]的方法计算病情指数和防治效果。
病情指数=∑(各级病株数×相应级数)/(病级最高级×调查总植株数)×100;
防治效果(%)=(对照组病情指数–处理组病情指数)/对照组病情指数×100。
1.8 拮抗细菌的鉴定将具有较强定殖能力和防效能力的拮抗细菌进行鉴定。
1.8.1 形态学鉴定将拮抗细菌划线接种于NA固体培养基上,30 ℃暗培养,观察菌落形态,主要包括菌落颜色、透明度、边缘特征等,并进行革兰氏染色及芽胞染色。
1.8.2 生理生化鉴定参照《常见细菌系统鉴定手册》[]和《伯杰细菌鉴定手册》[],采用细菌生理生化鉴定管对拮抗细菌糖醇利用、甲基红试验、V-P试验、明胶液化、淀粉水解和吲哚试验等生理生化指标进行测定。
1.8.3 分子鉴定采用细菌基因组试剂盒提取拮抗细菌基因组DNA。采用细菌16S rRNA基因通用引物16S1F和16S1R进行PCR扩增16S rRNA基因序列[]。PCR产物纯化后送至生工生物工程(上海)股份有限公司测序,根据测序结果在NCBI进行相似性比较分析,确定亲缘关系。用MEGA 5.0软件采用邻接法构建基于16S rRNA基因序列的系统发育树,自展次数设定为1 000,确定拮抗菌株的系统发育学地位。
2 结果与分析 2.1 土壤细菌的分离和拮抗细菌筛选结果采用稀释平板法,从关防风根际土壤中共分离出157株细菌,编号为SC-1–SC-157。初筛获得40株对木贼镰刀菌具有明显拮抗效果的细菌菌株,占总菌数的25.48%。复筛结果显示,拮抗细菌的无菌滤液对木贼镰刀菌具有拮抗抑制作用的有20株,抑菌率最高可达到70.24%,表明拮抗细菌分泌的胞外物质同样对木贼镰刀菌具有拮抗作用。选取抑菌率高于65%的5株拮抗细菌进行下一步定殖研究。
2.2 抗利福平突变菌株的筛选结果菌株SC-16和SC-119均能在含300 μg/mL Rif的NA固体培养基上稳定生长,并且在不含Rif的NA固体培养基上连续培养10代后,均能在含300 μg/mL Rif的NA固体培养基上正常生长,其发酵液对木贼镰刀菌仍具有抑制作用,抑制效果与原始菌株基本相同,具有遗传稳定性和拮抗稳定性。
2.3 抗利福平突变菌株在土壤中的定殖结果菌株SC-16和SC-119在土壤中的定殖动态()呈现“先减后增再趋于平稳”的趋势。菌株SC-16接种7 d后,土壤中突变菌株数量明显下降,但7 d后土壤的含菌量逐渐增加,于第14天达到峰值,为5.13×107 CFU/g,为7 d时的1.52倍;菌株SC-119接种14 d后,土壤中突变菌株数量明显下降,但14 d后土壤的含菌量逐渐增加,于第21天达到峰值,为6.87×107 CFU/g,为14 d时的1.54倍;2株突变细菌含菌量达到峰值后开始逐渐减少,并于28 d后土壤含菌量趋于稳定;35 d时,菌株SC-16和SC-119在土壤中的含菌量仍能达到4.83×106 CFU/g-土和3.45×107 CFU/g-土,说明菌株SC-16和SC-119能在土壤中较长时间定殖。
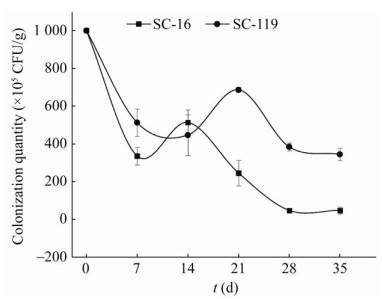
图 1 菌株SC-16和SC-119在土壤中的定殖动态 Figure 1 The colonization dynamic of SC-16 and SC-119 in soil.
2.4 拮抗细菌抗菌谱测定结果
菌株SC-16和SC-119对9种供试病原真菌均表现出明显的抑菌能力(),其中对槭菌刺孢菌抑制效果最好,抑菌率达到了96.27%和96.26%,显著高于其他供试病原真菌(P < 0.05)。菌株SC-16和SC-119对其他8种供试病原真菌抑菌率可达到80.52%−86.40%和72.48%−84.85%,表明菌株SC-16和SC-119具有较强的广谱抑菌效果,而且菌株SC-16较SC-119广谱抑菌能力强。
表 1 拮抗细菌的抑菌谱测定结果 Table 1 Antifungal spectrum of antagonistic bacteria
Phytopathogenic fungus
SC-16
SC-119
Inhibition rate (%)
Inhibition rate (%)
Rhizoctonia solani
81.66±1.30cde
72.48±2.52e
Botrytis cinerea
84.37±2.12bcd
73.28±1.50e
Fusarium oxysporum
81.32±1.88de
82.46±2.69bc
Phytophthora cactorum
86.40±0.66b
74.74±0.85e
Alternaria liriodendra
82.22±2.12cde
79.25±3.56cd
Fusarium solani
84.64±0.46bc
84.85±1.81b
Alternaria tenuissima
83.45±0.65bcde
79.63±0.17cd
Mycocentrospora acerina
96.27±1.31a
96.26±0.78a
Sclerotinia asari
80.52±0.17e
76.04±0.57de
注:表中数据为平均数±标准差。不同小写字母表示经Duncan氏新复极差法检验差异显著(P < 0.05)
Note: Date in the table are mean±SD. Different letters in the same row indicate significant difference at P < 0.05 level by Duncan’s new multiple range test.
2.5 拮抗细菌盆栽防效研究结果
菌株SC-16和SC-119对关防风根腐病的盆栽防效如所示,单接木贼镰刀菌的病情指数为56.79,其他处理组病情指数均较单接木贼镰刀菌显著降低(P < 0.05)。其中,木贼镰刀菌与SC-16混合接种后,其相对防效较接种哈茨木霉菌剂和枯草芽胞杆菌菌剂分别提高了8.31%和12.50%,但与代森锰锌处理相比防效降低了7.80%;木贼镰刀菌与SC-119混合接种后,其相对防效较接种哈茨木霉菌剂、枯草芽胞杆菌菌剂和代森锰锌分别提高了29.03%、32.26%和16.13%;各处理组之间相对防效差异不显著,进一步表明了拮抗细菌SC-16和SC-119对关防风根腐病均具有较好的防治效果,但SC-119较SC-16的防治效果好。
表 2 拮抗细菌对关防风根腐病的防治效果 Table 2 Control effect of antagonistic bacteria on F. equiseti
Treatment
Disease index
Control effect (%)
1
56.79±7.41a
2
29.63±4.28b
47.83±6.79a
3
30.86±7.41b
45.65±11.76a
4
24.69±7.71b
56.52±12.25a
5
27.16±4.28b
52.17±6.79a
6
18.52±7.41b
67.39±11.76a
注:1:木贼镰刀菌;2:木贼镰刀菌和哈茨木霉菌剂;3:木贼镰刀菌和枯草芽胞杆菌菌剂;4:木贼镰刀菌和代森锰锌;5:木贼镰刀菌和SC-16;6:木贼镰刀菌和SC-119。数据为平均数±标准差。不同小写字母表示经Duncan氏新复极差法检验差异显著(P < 0.05)
Note: 1: F. equiseti; 2: F. equiseti and Trichoderma harzianum; 3: F. equiseti and Bacillus subtilis; 4: F. equiseti and mancozeb; 5: F. equiseti and SC-16; 6: F. equiseti and SC-119. Date in the table are mean±SD. Different letters in the same row indicate significant difference at P < 0.05 level by Duncan’s new multiple range test.
2.6 拮抗细菌的鉴定结果 2.6.1 形态学鉴定结果
菌株SC-119在NA固体培养基培养48 h后,菌落呈乳白色,有黏性,质软,中心隆起,表面湿润,不透明,边缘不整齐,培养96 h后菌落及培养基颜色逐渐变为深褐色,有色素产生,菌体杆状,革兰氏阳性,有芽胞。
2.6.2 生理生化鉴定结果菌株SC-119的生理生化特性结果表明(),菌株SC-119能够水解淀粉和明胶,硝酸盐还原反应生成红色化合物,接触酶、丙酸盐、乙酰甲基甲醇试验(V-P)、酪蛋白和氧化酶均为阳性,能够利用柠檬酸盐和多种糖原,甲基红反应、吲哚、苯丙氨酸脱氨酶均为阴性,代谢过程不产生硫化氢(H2S)气体,能在含10% NaCl的NA培养基上生长。菌株SC-119与萎缩芽胞杆菌模式菌株均能利用甘露糖、不能利用甘露醇,而枯草芽胞杆菌模式菌株则反之,可据此有效区分萎缩芽胞杆菌及其近缘种[, ]。
表 3 菌株SC-119的生理生化特征 Table 3 Physiological and biochemical characteristics of SC-119
Characteristics
SC-119
1
2
V-P test
+
+
+
Methyl red test
−
−
−
Nitrate reduction
+
+
+
Citrate utilization
+
+
+
Catalase test
+
+
+
Gelaune liquefaction
+
+
+
Amylolysis
+
+
+
L-arabinose
+
+
+
D-xylose
+
+
+
D-mannitol utilization
+
+
+
Hydrogen sulfide production
−
−
−
Mannose
+
+
−
Mannitol
−
−
+
7% NaCl growth
+
+
+
10% NaCl growth
+
+
+
Propionate
+
+
+
Indole test
−
−
−
Hydrolyzed casein
+
+
+
Oxidase
+
+
+
Phenylalanine ammonia lyase
−
−
−
注:1:萎缩芽胞杆菌模式菌株;2:枯草芽胞杆菌模式菌株。+:阳性;−:阴性
Note: 1: Bacillus atrophaeusT; 2: Bacillus subtilisT. +: Positive; −: Negative.
2.6.3 分子鉴定结果
采用PCR扩增菌株SC-119的16S rRNA基因序列,得到1 454 bp的PCR产物,提交GenBank注册(登录号为OK605033)并进行NCBI BLAST比对,结果显示菌株SC-119与萎缩芽胞杆菌(Bacillus atrophaeus)相似性最高,达到99.86%,基于16S rRNA基因序列构建的系统发育树显示(),菌株SC-119与萎缩芽胞杆菌(Bacillus atrophaeus)聚为一支。
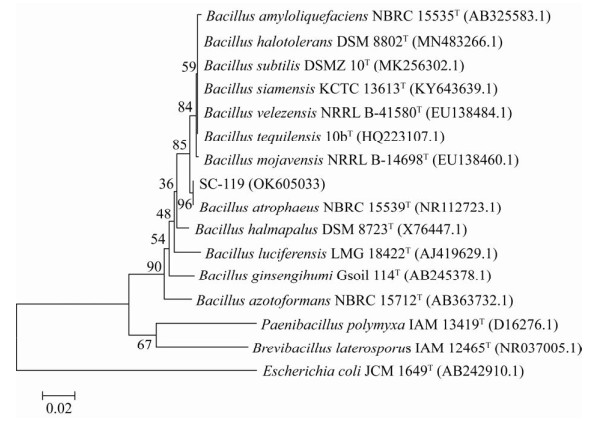
图 2 基于16S rRNA基因序列构建的菌株SC-119系统发育树标尺代表遗传变异系数;分支上的数字表示置信度;括号中的序号表示该菌在GenBank数据库中的登录号 Figure 2 phylogenetic tree of SC-119 strain based on 16S rRNA gene sequence. The scale represents the coefficient of genetic variation; The number at the branch represents the confidence interval; The serial number in parentheses indicates GenBank accession number.
结合形态学特征、生理生化特性、16S rRNA基因序列分析,将菌株SC-119鉴定为萎缩芽胞杆菌(Bacillus atrophaeus)。
3 讨论与结论植物根际是植物与外界环境进行物质交换的重要场所,植物根际土壤聚集了种类繁多且数量庞大的微生物群落[],尤以根际细菌为主[-]。根际细菌可通过与病原菌争夺有利的生态位点,从而达到抑制病原菌在植物根际中生长繁殖的目的,具有良好的防病潜能[-]。本研究通过平板对峙法从健康关防风根际土壤中分离筛选出一株对木贼镰刀菌具有良好拮抗效果的拮抗细菌SC-119,无菌滤液抑菌率可达68.53%,具有良好的生防潜力。
研究表明,植物根际细菌具有广谱抑菌活性,可同时对多种病原真菌具有拮抗作用。孙卓等[]从人参根际土壤中分离出的拮抗细菌SZ-35,可抑制辣椒疫霉病菌、番茄灰霉病菌等14种植物病原真菌的生长;李新宇等[]从黄瓜根际土中分离出拮抗细菌ZF57,对番茄根腐病菌、白菜茎基腐病菌和番茄早疫病菌等7种植物病原菌也具有较好拮抗效果。本研究证实菌株SC-119对细辛叶枯病菌、刺五加黑斑病菌、细辛菌核病菌等9种作物病原真菌均表现出不同程度的抑菌能力,其中对槭菌刺孢菌抑制效果最好,抑菌率达到了96.26%,表明菌株SC-119不但对根部病害病原菌具有拮抗作用,而且对其他茎、叶部病害病原菌同样具有拮抗效果,表现出其广谱抑菌活性。
研究表明,筛选出的拮抗菌株在室内与病原菌互作时虽表现出较强的抑制效果,但在实际应用中,由于外界环境条件的影响,生防菌在与土壤土著微生物的竞争中不易长期定殖生存并占据优势,因而极大地影响了它们的实际防病效果[-]。因此,筛选出能在植物根际中长期稳定定殖的拮抗细菌是关防风根腐病生物防治的重要环节[]。本研究发现,经利福平标记的突变菌株SC-119在土壤中的定殖动态呈现“先减后增再趋于稳定”的趋势,其中,菌株SC-119在土壤中定殖21 d内,含菌量急速下降而后上升达到最大值,这可能是突变菌株施入前期受到土壤土著微生物的竞争或其他环境因子的影响[],致使菌株SC-119生长受到抑制,之后其在土壤中占据有利竞争位点取代原有微生物并已适应新环境,因此含菌量上升;但21 d后土壤含菌量再次下降,分析原因可能是由于后期土壤中营养物质逐渐减少,突变菌株缺乏生长所需营养条件所致。同时,由于育苗盆中未栽入关防风植株,致使突变菌株无法依附于植物根系,这可能也是菌株SC-119含菌量下降的原因之一。即便如此,本研究筛选出的突变菌株SC-119在上述环境中定殖35 d后其含菌量仍能达到3.45×107 CFU/g-土,表明其具有较强的定殖能力。
盆栽防病试验表明,各处理组施入相同浓度菌液时,菌株SC-119能显著降低关防风根腐病的病情指数,其防效高于菌剂和农药处理组。充分表明菌株SC-119对关防风根腐病具有良好的防治效果,与市面上推广的生物菌剂相比更能针对性地防治关防风根腐病,同时,从关防风根际土壤分离筛选出的拮抗细菌保证了关防风拮抗菌源的安全性和可靠性。
本研究经形态学、生理生化特性和16S rRNA基因序列分析,鉴定菌株SC-119为萎缩芽胞杆菌(Bacillus atrophaeus)。萎缩芽胞杆菌是一类可产生芽胞的非致病菌,对人与动物无致病性,能够产生多种次级代谢产物,具有防病促生[]、抗病毒[]、降解重金属[]等生态作用,被广泛应用于植物病害的生物防治研究。本研究首次发现萎缩芽胞杆菌对于关防风根腐病具有良好的生防效果,为关防风根腐病的防治提供了优良菌源,但有关菌株SC-119的大田试验、发酵条件及抑菌机制仍需要进一步研究。